医療機器基準等原案作成要綱
独立行政法人医薬品医療機器総合機構
医療機器調査・基準部 医療機器基準課
2023年5月現在
1. はじめに
当該要綱は、医療機器の基準作成の効率化を図る一環として、認証基準等を作成する上での標準的な記載事項及び基本的考え方・解釈等を示したものです。
2. 認証基準 ( → 認証基準の概要)
2.1 原案作成要綱
医療機器認証基準原案作成要綱  ver.1.2
ver.1.2
<最終改訂:2022年10月18日>
2.2 認証基準(案)作成時に必要なもの
2.2.1 ヒアリング時及び最終原案送付時に準備する資料等(制定)
| 認証基準案 | 取扱い案 | 基本要件 | |||
| CL案 | 「適/不適」一覧 | ||||
| ヒアリング時 | 〇 | 〇※ | 〇※ | 〇※ | |
| 最終原案送付時 | 〇 | 〇※ | 〇※ | 〇※ | |
| テンプレート (制定) |
別表1 |
様式1-1 認証基準案(制定) |
様式2 取扱い案(制定) |
様式3 基本要件CL(制定) |
様式A CL適不適一覧 |
| 別表2 |
様式1-2 認証基準案(制定) |
||||
| 別表3 |
様式1-3 認証基準案(制定) |
||||
| 備 考 |
・上記以外に、説明用資料の作成に御協力いただく場合があります。
|
||||
※作成する場合
2.2.2 ヒアリング時及び最終原案送付時に準備する資料等(改正)
| 認証基準案 | 取扱い案 | 基本要件 | |||
| CL案 | 「適/不適」一覧 | ||||
| ヒアリング時 | 〇 | 〇※ | 〇※ | 〇※ | |
| 最終原案送付時 | 〇 | 〇※ | 〇※ | 〇※ | |
| テンプレート (改正) |
別表1 |
様式1-1 認証基準案(改正) |
様式2 取扱い案(改正) |
様式3 基本要件CL(改正) |
様式A CL適不適一覧 |
| 別表2 |
様式1-2 認証基準案(改正) |
||||
| 別表3 |
様式1-3 認証基準案(改正) |
||||
| 備 考 |
・最終原案送付時は、改正箇所の無い様式を含め清書版の基準案等一式(様式1、様式2、様式3及び様式A)及び、改正箇所を見え消しした資料(様式2/様式3(様式Aを含む))を提出。
(加筆文字:「赤字+下線」、削除:「緑字+取消線」) |
||||
※作成する場合
3. 承認基準 ( → 承認基準の概要)
3.1 原案作成要綱
医療機器承認基準原案作成要綱  ver.1.2
ver.1.2
<最終改訂:2022年10月18日>
3.2 承認基準(案)作成時に必要なもの(制定/改正)
| 承認基準案 | 技術基準案 | 基本要件 | |||
| CL案 | 「適/不適」一覧 | ||||
| ヒアリング時 | 〇 | 〇 | 〇※ | 〇※ | |
| 最終原案送付時 | 〇 | 〇 | 〇※ | 〇※ | |
| テンプレート | 制定 |
様式1 承認基準案(制定) |
様式2 技術基準案(制定) |
様式3 基本要件CL(制定) |
様式A CL適不適一覧 |
| 改正 |
様式1 承認基準案(改正) |
様式2 技術基準案(改正) |
様式3 基本要件CL(改正) |
||
| 備 考 |
・上記以外に、説明用資料の作成に御協力いただく場合があります。 |
||||
※作成する場合
4. 標準的な基準作成フロー
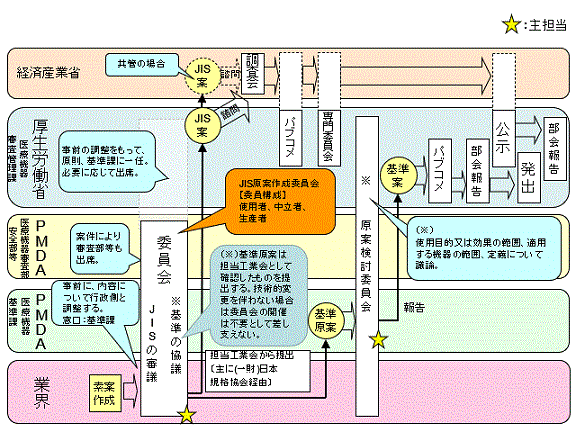
図1 基準の標準的な作成プロセス
5. 記載要綱及び様式等のダウンロード [ZIP形式]
<参考>