医療機器基準等原案作成要綱 旧情報としてご参照ください(2014年11月25日改正)
独立行政法人医薬品医療機器総合機構規格基準部医療機器基準課
(旧 審査マネジメント部医療機器基準課)
2010年3月3日改正
1. はじめに
当該要綱は、基準作成の効率化を図る一環として、認証基準及び承認基準等を作成する上での標準的な記載事項並びに基本要件適合性チェックリストを作成する際の基本要件条文の基本的考え方・解釈等を示したものである。
2. 認証基準
2.1 定義
「認証基準」とは、登録認証機関がその基準への適合性を確認することにより認証審査を行う医療機器等に関する基準をいい、厚生労働大臣が定める。
2.2 構成
(認証基準)
1) 適用範囲:対象となる医療機器を一般的名称によって指定
2) 技術基準:日本産業規格(JIS)を指定
3) 使用目的、効能又は効果:基準の対象となる使用目的、効能又は効果を規定
(基本要件への適合性)
上記認証基準に加え、「薬事法第41条第3項の規定により厚生労働大臣が定める医療機器の基準」(平成17年3月29日厚生労働省告示第122号)への適合性を確認するためのチェックリストを策定(基本要件基準適合性チェックリスト)。
2.3 基準(案)作成時に必要なもの
| 資 料 名 | 様 式 | 記載方法(書式等) | |
| (1) | 認証基準(案) | 様式1( |
様式1の記載方法 |
| (2) | 基本要件基準適合性チェックリスト(案) | 様式3( |
様式3の記載方法 基本要件の基本的考え方等 |
| (3) | 当該基準の技術基準となるJIS又はJIS(案) | - | - |
| (4) | 基準改正の場合は、上記(1)、(2)及び(3)について改正箇所を見え消しした資料(様式は同じものを用いる)。 なお、(3)はすべての変更箇所の新旧対照表(変更理由を付記)でも可。 |
- | 加筆文字:「赤字+下線」 削除文字:「緑字+取消線」 |
2.4 基本要件基準適合性チェックリスト正誤表
3. 承認基準
3.1 定義
「承認基準」とは、その基準への適合性を確認することにより承認審査を行う医療機器等に関する基準をいう。なお、承認基準は、原則、国際規格等(ISO/IEC等)からなり、臨床試験成績に関する資料の添付が不要の範囲の品目について定める(薬食発第0216002号平成17年2月16日付け通知参照)。
3.2 構成
(承認基準)
1) 適用範囲:対象となる医療機器を一般的名称によって指定
2) 技術基準: JIS、ISO/IEC等に基づき性能、機能、有効性等に関する項目を規定
3) 使用目的、効能又は効果:基準の対象となる使用目的、効能又は効果を規定
4) 「薬事法第41条第3項の規定により厚生労働大臣が定める医療機器の基準」(平成17年3月29日厚生労働省告示第122号)への適合性を確認するためのチェックリスト(基本要件基準適合性チェックリスト)。
3.3 基準(案)作成時に必要なもの
| 資 料 名 | 様 式 | 記載方法(書式等) | |
| (1) | 承認基準(案) | 様式2-1( |
様式2-1の記載方法 |
| (2) | 承認基準における技術基準(案) 技術基準がJISの場合は、該当JIS又はJIS(案)を含む |
様式2-2( |
様式2-2の記載方法 |
| (3) | 基本要件基準適合性チェックリスト(案) | 様式3( |
様式3の記載方法 基本要件の基本的考え方等 |
| (4) | 基準改正の場合は、上記(1)、(2)及び(3)について改正箇所を見え消しした資料(様式は同じものを用いる)。 なお、(3)はすべての変更箇所の新旧対照表(変更理由を付記)でも可。 |
- | 加筆文字:「赤字+下線」 削除文字:「緑字+取消線」 |
4. 標準的な基準作成フロー
*基準(基準作成を意図したJIS等を含む)の新規作成又は改正等に係る事項は、規格基準部医療機器基準課までご相談下さい。
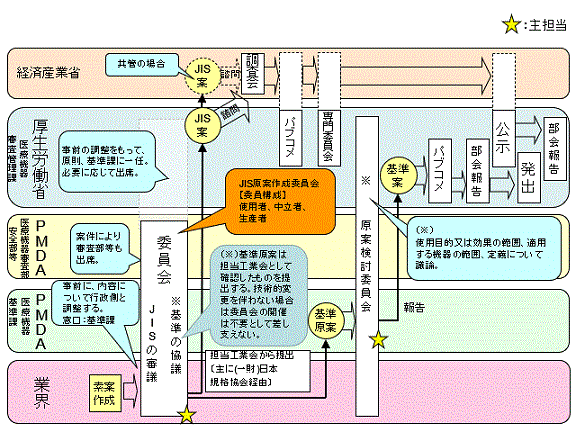
図1 認証基準及び承認基準の標準的な作成プロセス